สมดุลเคมี
สมดุลเคมี (Chemical equilibrium)
สมดุลเคมี (Chemical equilibrium) คือสภาวะที่ความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์ไม่เปลี่ยนแปลงอีกแม้เวลาผ่านไป เราจะเรียกว่าปฏิกิริยาเคมีนั้นอยู่ในสมดุล (equilibrium)
กระบวนการเปลี่ยนแปลงทางวิทยาศาสตร์มี 3 รูปแบบ คือ การเปลี่ยนสถานะ การละลาย และการเกิดปฏิกิริยาเคมี จำแนกเป็น 2 ลักษณะคือ
- การเปลี่ยนแปลงที่เกิดขึ้นทางเดียวไม่ย้อนกลับ (Inreversible reaction) หมายถึงเมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นอีกสิ่งหนึ่งแล้ว สิ่งที่เกิดขึ้นจากการเปลี่ยนแปลงนี้จะไม่สามารถเปลี่ยนกลับมาสู่ภาวะเดิมได้โดยทันที
- การเปลี่ยนแปลงที่ผันกลับได้หรือย้อนกลับได้ (Reversible reaction) มีลักษณะที่สำคัญคือเมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นสิ่งใหม่แล้ว สิ่งใหม่ที่เกิดขึ้นก็สามารถเปลี่ยนกลับมาเป็นสิ่งเดิมได้ทันที การเปลี่ยนแปลงลักษณะนี้จะเกิดภาวะสมดุลขึ้นได้

💬 ภาวะสมดุล ( Equilibrium state )
คือ ภาวะของระบบที่มีอัตราการเปลี่ยนแปลงไปข้างหน้าเท่ากับอัตราการเปลี่ยนแปลงย้อนกลับที่สมดุลจะมีสารตั้งต้นทุกชนิดเหลืออยู่ และผลิตภัณฑ์ที่เกิดขึ้นทุกชนิดคงที่ ภาวะสมดุลจะเกิดกับระบบที่มีการเปลี่ยนแปลง
💬 สมบัติของระบบ ณ ภาวะสมดุล
1.ต้องเป็นปฏิกิริยาที่ผันกลับได้ โดยต้องเกิดในระบบปิด
2.มีปฏิกิริยาไปข้างหน้าและย้อนกลับเกิดขึ้นตลอดเวลา โดยจำนวนโมลของสารตั้งต้นและผลิตภัณฑ์คงที่แต่อาจเท่ากันหรือไม่เท่ากันก็ได้ และอัตราการเกิดปฏิกิริยาไปข้างหน้าเท่ากับปฏิริยาย้อนกลับ
3.สมบัติของระบบคงที่ (จำนวนโมล,สีของสาร,ความดันและอุณหภูมิคงที่)
💬 ภาวะสมดุลระหว่างสถานะ
สารต่างๆสามารถเปลี่ยนสถานะได้ โดยมีการเปลี่ยนแปลงพลังงานควบคู่ไปด้วย ดังแผนภาพนี้

ที่ภาวะสมดุลของปฏิกิริยาเคมีระบบยังไม่ได้หยุดนิ่ง ยังมีทั้งการเกิดปฏิกิริยาไปข้างหน้า และเกิดปฏิกิริยาย้อนกลับตลอดเวลาโดยเกิดในอัตราที่เท่ากัน เรียกภาวะสมดุลนี้ว่า ภาวะสมดุลไดนามิก
💬 สมดุลไดนามิก แบ่งออกเป็น 2 ประเภท ดังนี้
1.สมดุลเนื้อเดียวกัน (Homogeneous Chemical Equilibrium) เป็นสมดุลที่มีสารทุกชนิดอยู่ในสถานะเดียวกันหมด
2.สมดุลเคมีมีเนื้อผสม (Heterogeneous Chemical Equilibrium) เป็นสมดุลที่มีสารต่างๆมากกว่า 2 สถานะอยู่ในระบบเดียวกันหมด
💬 กราฟของสมดุลเคมี
1.กราฟระหว่างอัตราการเกิดปฏิกิริยากับเวลา
- อัตราการเกิดปฏิกิริยาไปข้างหน้า = อัตราการเกิดปฏิกิริยาย้อนกลับ
2.กราฟระหว่างความเข้มข้นของสารกับเวลา
- สารตั้งต้น มากกว่า ผลิตภัณฑ์
ที่มา : https://bit.ly/3ntMAPn
- สารตั้งต้น น้อยกว่า ผลิตภัณฑ์
- สารตั้งต้น เท่ากับ ผลิตภัณฑ์
💬 ค่าคงที่สมดุล
ปฏิกิริยาที่ผันกลับได้ ที่ภาวะสมดุล ผลคูณของความเข้มข้นของสารผลิตภัณฑ์ เมื่อหารด้วยผลคูณของความเข้มข้นของสารตั้งต้นที่เหลือ โดยที่ความเข้มข้นของสารแต่ละชนิดยกกำลังด้วยเลขสัมประสิทธิ์บอกจำ นวนโมลของสารในสมการที่ดุลแล้วจะมีค่าคงที่เสมอเมื่ออุณหภูมิคงที่
กำหนดให้สมดุลปฏิกิริยาเป็น aA + bB ⇌ cC + dD
💬 ค่าคงที่สมดุลกับสมการเคมี
💬 ขั้นตอนการหาค่าคงที่สมดุล
1. เขียนสมการเคมี
2. ดุลสมการเคมี
3. ณ จุดสมดุล หาความเข้มข้นของผลิตภัณฑ์
4. ณ จุดสมดุล หาความเข้มข้นของ สารตั้งต้นที่เหลือ
5. เขียนค่า K และแทนค่าความเข้มข้น ของสารผลิตภัณฑ์ และสารตั้งต้นลงในสมการค่า K
💬 ผลของการเปลี่ยนแปลงความเข้มข้น ความดันและอุณหภูมิ
- การเพิ่มหรือลดความเข้มข้นของสารหนึ่งสารใดในปฏิกิริยาเคมี เป็นเหตุให้ภาวะสมดุลเปลี่ยนไป แต่ค่าคงที่สมดุลยังคงเดิม
- ถ้าความดันของระบบเพิ่มขึ้น สมดุลจะเลื่อนไปทางฝ่ายที่มีจำนวนโมลน้อย * ในกรณีที่โมลเท่ากัน ความดันจะไม่มีผลต่อสมดุล *
- ผลของการเปลี่ยนแปลงอุณหภูมิที่มีต่อภาวะสมดุล จะเกิดสมดุลปฏิกิริยาคายความร้อน หรือสมดุลปฏิกิริยาดูดความร้อน
💬 หลักของเลอชาเตอลิเอ
การเปลี่ยนความเข้มข้นของสารทำได้โดยเพิ่ม เติม สารใดสารหนึ่งลงไปในระบบอรก หรือเอาสารนั้นออกจากระบบ
- เพิ่มความเข้มข้น ไปในทิศทางที่จะลดความเข้มข้น
- ลดความเข้มข้น ไปในทิศทางที่จะเพิ่มความเข้มข้น
- ระบบจะเข้าสู่สมดุลใหม่อีกครั้ง สมบัติจะต่างไปจากเดิม
- เพิ่มความดัน หรือลดปริมาตร ไปในทิศทางที่มีจำนวนโมลก๊าซน้อยกว่า
- ลดความดัน ไปทางจำนวนโมลก๊าซมากกว่า
- จำนวนโมลของก๊าซสารตั้งต้นและผลิตภัณฑ์เท่ากัน ไม่มีผลต่อภาวะสมดุล
ระบบที่อยู่ในภาวะสมดุลเมื่ออุณหภูมิเปลี่ยนไปภาวะสมดุลจะเปลี่ยนไป และมีผลทำให้ค่าคงที่สมดุล (K) เปลี่ยนไปด้วย
- ปฏิกิริยาดูดความร้อน จะเกิดปฏิกิริยาไปข้างหน้าได้ดีเมื่ออุณหภูมิเพิ่มขึ้น
- ปฏิกิริยาคายความร้อน จะเกิดปฏิกิริยาไปข้างหน้าได้ดีเมื่ออุณหภูมิลดลง



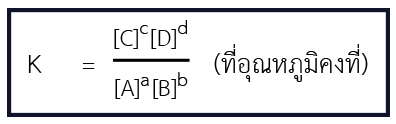





ความคิดเห็น
แสดงความคิดเห็น